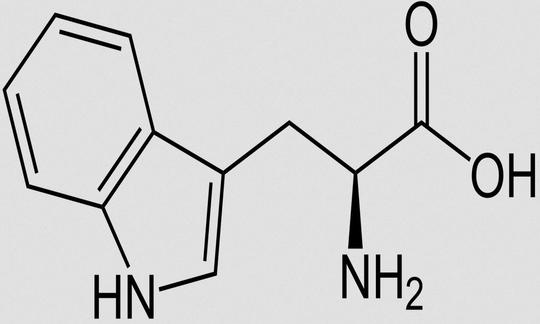
Tryptophan (Trp, W)
Tryptophan, die essenzielle Aminosäure für Körper und Geist. Neben seiner bedeutenden Rolle in der Proteinsynthese spielt Tryptophan auch eine Schlüsselrolle bei der Regulierung von Stimmung und Schlaf.
Lesen Sie im Fachbeitrag über die Vor- und Nachteile, Wirkungen etc. von Tryptophan und welche natürlichen Lebensmittel die Besten dafür sind.
Die Versorgung mit Makro- und Mikronährstoffen ist bei einer ausgewogenen, pflanzenbasierten Ernährung mit wenig bis keinen industriell verarbeiteten Lebensmitteln in der Regel gegeben, mit Ausnahme von Vitamin B12. Doch vor allem sekundäre Pflanzenstoffe sind relevant für die Aufrechterhaltung der Gesundheit und Heilung von Krankheiten, obwohl sie nicht als essenzielle Nährstoffe gelten - ausser Vitamine.
---
Definition
Tryptophan (Trp, W) ist eine von acht (bei Kindern zehn, einschliesslich Histidin und Arginin) Aminosäuren, die für den menschlichen Organismus als essenziell (nicht entbehrlich) gelten. Der Mensch verwendet 21 proteinogene Aminosäuren. Das sind die Bestandteile der Proteine. Bis auf zwei (Lysin und Threonin) kann der Körper die Proteine seinem Bedarf anpassen, auch wenn man klassisch acht als essenziell bezeichnet.5
Vorkommen
Besonders reich an Tryptophan sind Samen, Hülsenfrüchte und Gewürze.
| Lebensmittel | Protein g/100 g (USDA) | Tryptophan mg/100 g | %-Anteil Tryptophan am Protein |
| 30 g | 1461 mg | 4,9 % | |
| 12 g | 747 mg | 6,2 % | |
| 36 g | 591 mg | 1,6 % | |
| 33 g | 436 mg | 1,3 % | |
| 18 g | 388 mg | 2,2 % | |
| 32 g | 369 mg | 1,2 % | |
| 21 g | 348 mg | 1,7 % | |
| 23 g | 317 mg | 1,4 % |
Unter den Hülsenfrüchten bieten Moong Dal (1200 mg/100 g), Goabohne (762), Kidney-Bohnen (300 mg), Borlotti-Bohnen (270) sowie Mungbohnen (260) einen höheren Gehalt an Tryptophan.1
Bei Nüssen und Samen haben unter anderem Kürbiskerne (580), Sesambutter (Tahin, 393), Leinsamen (297 mg) und Pistazien (250) hohe Tryptophangehalte.1
Einige bedeutende Tryptophan-Lieferanten wie Spirulina (929 mg/100 g), getrocknete Petersilie (475), Senfkörner (502 mg), Bockshornkleesamen (391), schwarzer Senf (380 mg), getrockneter Bärlauch (360) oder Senfpulver (260 mg) isst man in zu geringen Mengen, weshalb wir sie in der Tabelle nicht führen. Auch prozessierte vegane Zutaten können hohe Anteile an Tryptophan aufweisen, wie z.B. Sesammehl (1097) oder Baumwollsaatmehl (752).1
Alle oben genannten Zutaten liefern deutlich mehr Tryptophan als Fleisch oder Fisch. Zum Vergleich: Eier enthalten etwa 107 mg, Milch nur 80 mg.1
Viele Getreidesorten haben einen geringen Gehalt an essenziellen Aminosäuren, und Tryptophan ist in Gemüse und Früchten nur in kleinen Mengen vorhanden. Dennoch müsste man sich als Veganer sehr einseitig ernähren, um einen dauerhaften Eiweissmangel zu erleiden. Krankheiten wie Kwashiorkor und Marasmus, die durch lang anhaltenden Eiweiss- und generellen Energiemangel entstehen, sind in der westlichen Welt kaum noch zu finden.
L-Tryptophan findet häufig als Nahrungsergänzungsmittel Verwendung und dient insbesondere als stimmungsaufhellendes Mittel, da es ein Vorläufer von Serotonin ist. Seine Aufnahme steht daher in engem Zusammenhang mit der Unterdrückung von depressiven und ängstlichen Stimmungen.16
Lager- und Zubereitungsverluste
Das Erhitzen der Speisen denaturiert Proteine und verändert damit deren Eigenschaften. Ein Beispiel ist das Spiegelei, das durch die Hitze in der Pfanne denaturiert. Beim Erhitzen des Eies verfestigen sich das flüssige Eigelb und das Eiklar, die Hauptproteinquelle. Die Proteine im Ei verdicken sich, ein Prozess, der als "Gerinnung" oder "Ausflocken" bekannt ist. Das Eiklar gerinnt bei 60 °C, das Eigelb bei 65 °C, und die vollständige Gerinnung erfolgt bei 70 °C.8
Die Proteinoxidation einer Aminosäure durch reaktive Sauerstoffspezies kann dessen Funktion erheblich beeinflussen.
Ernährung - Gesundheit
Tryptophan ist eine für alle Tiere essenzielle Aminosäure, die Bakterien, Pilze und Pflanzen synthetisieren, während Menschen sie ausschliesslich über die Nahrung aufnehmen müssen. Neben seiner Rolle in der Proteinsynthese dient Tryptophan auch als Substrat für die Bildung verschiedener Neurotransmitter und Hormone. Es ist unter anderem ein Vorläufer für die Synthese von Serotonin im Gehirn und Darm sowie von Melatonin in der Zirbeldrüse.9,11 Tryptophan-Metaboliten wie Melatonin und ähnliche Substanzen wie Indol-3-Propionsäure sind starke Antioxidantien und bioenergetische Wirkstoffe, die die Regeneration und den Schutz vor Stress und Alterung erleichtern.10
Ferner ist Tryptophan wichtig für die Zellen der Darmschleimhaut und spielt eine Rolle bei der Regulierung des Immunsystems, der Darmflora, der Epithelbarriere und des Gleichgewichts im Darm.12
Inzwischen weiss man, dass der Körper nur Lysin und Threonin irreversibel transaminiert und nur die zwei wirklich essenziell sind.5 Veganer mit gesundem Essverhalten bekommen Tryptophan mehr als in doppelter Dosis der benötigten Menge.
Spezielle Essgewohnheiten, wie bei Frutariern (Fructarier, Frutaner, Fruganer) oder der 80/10/10 (High-Carb-Diät) und noch extremeren Diäten, können im Laufe der Zeit zu Mangelerscheinungen führen. Dies geschieht oft über lange Zeit ohne direkt erkennbare Symptome.
Das Rezept Erb-Müsli zeigt, dass man sich auch mit einem 80/10/10-Anteil gesund ernähren kann. Es enthält frische, natürliche Zutaten, die leicht erhältlich sind.
| Nicht nur Veganer oder Vegetarier sollten das Lesen: Veganer essen oft ungesund. Vermeidbare Ernährungsfehler. |
Tagesbedarf auf lange Sicht
Die WHO empfiehlt eine tägliche Aufnahme von 4 mg Tryptophan pro kg Körpergewicht.6 Für einen durchschnittlichen Erwachsenen mit 70 kg entspricht dies rund 280 mg pro Tag.
Allerdings beträgt der Mindestbedarf an Tryptophan inkl. 30 % Zuschlag für individuelle Schwankungen nach wissenschaftliche Tabellen Geigy, Bd.2, S. 232 nur 3 mg/kg Körpergewicht. Das wären für einen 70 kg schweren Menschen 210 mg/Tag.
Mangelerscheinungen bzw. Mangelsymptome
Ein Mangel an Tryptophan tritt selten auf. Eine natürliche vegane Ernährung deckt Tryptophan gut ab und bei mehr Muskelarbeit isst man auch mehr. Säuglinge sind besonders gefährdet, wenn sie von Muttermilch zu früh entwöhnt sind und falsche Nahrung erhalten.
Ernährungsphysiologen erkannten, dass ein schwerer ernährungsbedingter Mangel an Tryptophan oder Vitaminen der B-Gruppe beim Menschen zu Problemen im Zentralnervensystem (ZNS) führen kann. Dazu gehören Ataxie (Bewegungsstörung), kognitive Beeinträchtigungen (Schwierigkeiten bei Denkprozessen wie Gedächtnis, Aufmerksamkeit oder Lernen) und Dysphorie (Zustand allgemeiner Unzufriedenheit oder Unwohlseins), oft begleitet von einer Hyperpigmentierung der Haut.13
Eine langfristige unzureichende Aufnahme von Tryptophan kann zu Müdigkeit und Abgeschlagenheit führen. Bei einer Fruktosemalabsorption können signifikant erniedrigte Serum-Tryptophanspiegel auftreten. Sehr selten treten die genetischen Erkrankungen Tryptophan-Malabsorptionssyndrom (Blaue-Windeln-Syndrom) und Hartnup-Syndrom auf. Diese sind auf einen Mangel an einem substratspezifischen Transportmechanismus für L-Tryptophan in der Dünndarm- und Nierenschleimhaut zurückzuführen.14
Überversorgung
Ein erhöhter Tryptophanspiegel tritt bei einer ausgewogenen Ernährung nicht auf. Da die Aminosäure ihren Abbau selbst reguliert, ist eine Überdosierung kaum möglich.
Eine übermässige Aufnahme von Tryptophan kann Nierenschäden verursachen, während eine moderate Menge vorteilhaft sein könnte. In einem Experiment fütterten Forscher gesunde Ratten 12 Wochen lang mit Diäten, die 0,6 %, 1,2 % und 1,8 % Tryptophan enthielten. Sie stellten fest, dass eine hohe Tryptophanaufnahme den Harnstoffstickstoff (BUN) im Blut erhöhte und Nierenschäden verursachte. In einem weiteren Experiment bekamen Ratten mit chronischer Nierenerkrankung (CKD) 8 Wochen lang Tryptophan in Dosen von 100 mg/kg oder 500 mg/kg. Eine hohe Dosis erhöhte die Sterblichkeit, Serumkreatinin, Harnstoffstickstoffwerte und Nierenschäden.12
Die tolerierbare obere Aufnahmemenge für Tryptophan beträgt 4,5 g pro Tag (Tolerable Upper Intake Level), was als sichere Grenze für die tägliche Einnahme gilt, um potenzielle gesundheitliche Risiken durch übermässigen Konsum zu vermeiden.15
Aus dem Buch China Study kann man eindrücklich und mit guten Beweisen erkennen, dass wir normalerweise am Zuviel und nicht an Mangel an Proteinen leiden (siehe ausführliche Buchbesprechung): Erst seit ein paar Jahren entdeckten Wissenschaftler, dass tierisches Eiweiss, was als beste Proteinqualität (biologische Wertigkeit) galt, nicht die beste Gesundheit erzeugt, sondern das Gegenteil.
Funktionen im Körper
Tryptophan weist folgende Funktionen im Körper auf:2,3,4,5
- L-Tryptophan ist am Aufbau von diversen Proteinen im menschlichen Körper beteiligt, z. B. in den Muskeln, im Apolipoprotein B100 (Teil des LDL-Cholesterin-Transportmoleküls) sowie in Enzymen.
- Es dient als Vorstufe für verschiedene Botenstoffe (Neurotransmitter, Hormone) wie Serotonin und Melatonin. Das Gewebshormon Serotonin reguliert viele Funktionen des Herz-Kreislauf-Systems, vor allem den Blutdruck. Auch als Botenstoff im Gehirn hat Serotonin vielfältige Aufgaben. Es wirkt stimmungsaufhellend, schlaffördernd und kann Emotionen positiv beeinflussen. Tryptophan gilt deshalb als natürliches Antidepressivum. Stress und ein dadurch erhöhter Cortisolspiegel wirken hemmend auf die Serotoninbildung, Nicotinsäure und Vitamin B6 hingegen fördernd.
- Tryptophan ist zudem die Vorstufe des Niacin (Nicotinsäure, Vitamin B3). Dieses B-Vitamin ist als NAD (Nicotinamid-Adenin-Dinukleotid) ein wichtiges Coenzym in verschiedenen Stoffwechselreaktionen.
Aufnahme und Stoffwechsel
Die Verdauung der mit der Nahrung aufgenommenen Proteine beginnt im Magen durch Pepsine. Sie spalten die Proteine in Peptide. Die weitere Spaltung in die einzelnen Aminosäuren geschieht im Dünndarm durch Peptidasen. Die zelluläre Aufnahme erfolgt durch verschiedene Carrierproteine, die spezifisch für bestimmte AS-Gruppen sind.
Am Trp-Stoffwechsel sind in erster Linie drei Stoffwechselwege beteiligt: 1. der Kynurenin- (Kyn), 2. der 5-Hydroxytryptamin- (HT) und 3. der Indol-Stoffwechselweg.17
- Kynurenin-Stoffwechselweg (Kyn): Der wichtigste Trp-Stoffwechselweg ist der Kynurenin-Stoffwechselweg; über diesen Weg lassen sich >95 % des Trp in mehrere bioaktive Verbindungen abbauen. Enzyme wie Tryptophan-2,3-Dioxygenase (TDO), Indolamin-2,3-Dioxygenase (IDO1) und IDO2 spielen hierbei eine entscheidende Rolle. Dieser Stoffwechselweg steht im Zusammenhang mit Entzündungen, Immunreaktionen und der Neurotransmission und ist mit verschiedenen Krankheiten assoziiert.
- 5-Hydroxytryptamin-Stoffwechselweg (HT): Der 5-Hydroxytryptamin-Stoffwechselweg spielt eine wichtige Rolle in verschiedenen physiologischen Prozessen. Tryptophan wandelt sich in 5-HTP und dann in 5-HT um. 5-HT ist ein wichtiger Neurotransmitter, der Schlaf, Kognition und Fressverhalten reguliert.
- Indol-Stoffwechselweg: Die Darmmikrobiota ist ebenfalls wichtig für den Trp-Stoffwechsel, indem sie Trp direkt in Moleküle wie Indol und seine Derivate umwandeln kann. Diese Moleküle sind wichtig für die Aufrechterhaltung der intestinalen Homöostase und regulieren die Expression von pro- und anti-inflammatorischen Zytokinen.17
Speicherung - Verbrauch - Verluste
Proteine unterliegen einem ständigen Auf- und Abbau. 70-80 % der freien Aminosäuren befinden sich in der Skelettmuskulatur, ein geringerer Anteil im Blutplasma. Das zentrale Organ für die AS-Regulation ist die Leber. Die Leber baut einen erheblichen Teil der Aminosäuren ab und beseitigt den Stickstoff in Form von Harnstoff. Über das Blut gelangt dieser via Nieren zur Ausscheidung.
Der Grossteil des Kynureninabbaus, etwa 90 %, erfolgt in der Leber durch die Umwandlung von Tryptophan in Kynurenin mittels Tryptophan-2,3-Dioxygenase (TDO). Der restliche Kynureninabbau erfolgt durch Indoleamin-2,3-Dioxygenase (IDO) im Gehirn, im Gastrointestinaltrakt und in der Leber.18 Die biologische Halbwertszeit von Tryptophan beträgt 15,8 Stunden.19
Eine Untersuchung an Ratten zeigte, dass die Enzymaktivität beim Tryptophan-Stoffwechsel teilweise mit zunehmendem Alter abnimmt. Dies kann zu einer verminderten Biosynthese von Nikotinsäure führen, die an fast allen biogenetischen und biosynthetischen Prozessen des Organismus beteiligt ist.7
Strukturen
Tryptophan ist eine proteinogene α-Aminosäure, die ein aromatisches Indol-Ringsystem aufweist. Zusammen mit Phenylalanin, Tyrosin und Histidin gehört Tryptophan zur Gruppe der aromatischen Aminosäuren.
IUPAC-Name: 2-Amino-3-(1H-indol-3-yl)propansäure. Weitere Namen: L(–)-α-Amino-β-indolyl-(3)-propionsäure. Summenformel: C11H12N2O2. Abkürzungen: Trp, W (Einbuchstabencode).19
Literaturverzeichnis - 19 Quellen (Link zur Evidenz)
| 1. | US-Amerikanische Nährwertdatenbank USDA. |
| 2. | Elmadfa I, Leitzmann C. Ernährung des Menschen. 5. Auflage. Verlag Eugen Ulmer: Stuttgart. 2015. |
| 3. | De Groot H, Farhadi J. Ernährungswissenschaft. 6. Auflage. Verlag Europa-Lehrmittel: Haan-Gruiten. 2015. |
| 4. | Kasper H, Burghardt W. Ernährungsmedizin und Diätetik. 11. Auflage. Elsevier GmbH, Urban & Fischer Verlag: München. 2009. |
| 5. | Biesalski HK, Grimm P. Taschenatlas der Ernährung. 6. Auflage. Georg Thieme Verlag: Stuttgart und New York. 2015. |
| 6. | WHO World Health Organization. Protein and amino acid requirements in human nutrition. Technical Report Series: 935. 2002. |
| 7. | Comai S, Costa CV et al. The effect of age on the enzyme activities of tryptophan metabolism along the kynurenine pathway in rats. Clin Chim Acta. 2005 Oct;360(1-2):67-80. |
| 8. | Ifst Institute of Food Science & Technology. Protein: Coagulation. 2017. |
| 9. | Höglund E, Øverli Ø et al. Tryptophan Metabolic Pathways and Brain Serotonergic Activity: A Comparative Review. Front Endocrinol. 2019;10:158. |
| 10. | Poeggeler B, Singh SK et al. Tryptophan in Nutrition and Health. Int J Mol Sci. 2022 May 13;23(10):5455. |
| 11. | Chojnacki C, Gąsiorowska A et al. Beneficial Effect of Increased Tryptophan Intake on Its Metabolism and Mental State of the Elderly. Nutrients. 2023 Feb 7;15(4):847. |
| 12. | Hu D, Liu J et al. Tryptophan intake, not always the more the better. Front Nutr. 2023 Apr 11;10:1140054. |
| 13. | Blankfield A. A Brief Historic Overview of Clinical Disorders Associated with Tryptophan: The Relevance to Chronic Fatigue Syndrome (CFS) and Fibromyalgia (FM). Int J Tryptophan Res. 2012;5:27-32. |
| 14. | Bissonnette B, Luginbuehl I et al. Blue diaper syndrome. In: Syndromes: Rapid Recognition and Perioperative Implications. 2nd ed. New York: McGraw-Hill Education. 2019. |
| 15. | Elango R. Tolerable Upper Intake Level for Individual Amino Acids in Humans: A Narrative Review of Recent Clinical Studies. Adv Nutr. 2023 Jul;14(4):885-894. |
| 16. | Kikuchi AM, Tanabe A et al. A systematic review of the effect of L-tryptophan supplementation on mood and emotional functioning. J Diet Suppl. 2021;18(3):316-333. |
| 17. | Xue C, Li G et al. Tryptophan metabolism in health and disease. Cell Metab. 2023 Aug 8;35(8):1304-1326. |
| 18. | Roth W, Zadeh K et al. Tryptophan Metabolism and Gut-Brain Homeostasis. Int J Mol Sci. 2021 Mar 15;22(6):2973. |
| 19. | National Library of Medicine, PubChem: Tryptophan. |
Für diese weisse Bohnen mit Apfel, Birne und Bratkartoffeln weicht man davor Bohnen über Nacht in Wasser ein. Im Buch findet sich ein passender Löwenzahnsalat.
Geräucherte Cashew-Croquetas, serviert mit in Portwein glasierter Roter Bete und aromatischer Orangenemulsion, sind leckere und vegane spanische Tapas mit Panko
Die Sojabohnen mit Spinat nach indischer Art sind einfach zuzubereiten und aufgrund des hohen Proteingehalts sehr sättigend.
Matcha Pulver besteht aus zermahlenen Blättern des Grüntees. Im Gegensatz dazu nimmt man dadurch beim Trinken mehr als nur wasserlösliche Inhaltsstoffe auf.
Der Steinpilz zählt zu den begehrtesten aller Speisepilze. In getrockneter Form (roh?) ist der Geschmack wesentlich intensiviert. Bio?
Moong Dal (Mung Daal), getrocknete, Mungbohnen (bio?), verwendet man ähnlich wie Linsen. Der hohe Lysin-Gehalt macht sie besonders wertvoll. Nie roh essen!





Kommentare