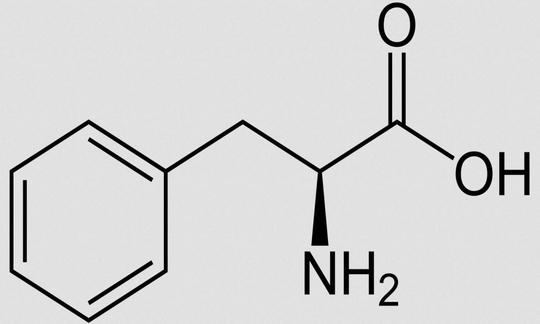
Phenylalanin (Phe, F)
Wussten Sie, dass Phenylalanin nicht nur für die Herstellung von Proteinen wichtig ist, sondern auch als Vorläufer für Neurotransmitter und das Hautpigment Melanin dient? Entdecken Sie bei uns, welche natürlichen Lebensmittel besonders reich an dieser essenziellen Aminosäure sind etc.
Die Versorgung mit Makro- und Mikronährstoffen ist bei einer ausgewogenen, pflanzenbasierten Ernährung mit wenig bis keinen industriell verarbeiteten Lebensmitteln in der Regel gegeben, mit Ausnahme von Vitamin B12. Doch vor allem sekundäre Pflanzenstoffe sind relevant für die Aufrechterhaltung der Gesundheit und Heilung von Krankheiten, obwohl sie nicht als essenzielle Nährstoffe gelten - ausser Vitamine.
---
Definition
Phenylalanin (Phe, F) ist eine von acht (bei Kindern zehn, einschliesslich Histidin und Arginin) Aminosäuren, die für den menschlichen Organismus als essenziell (nicht entbehrlich) gelten.3 Der Mensch verwendet 21 proteinogene Aminosäuren. Das sind die Bestandteile der Proteine. Bis auf zwei (Lysin und Threonin) kann der Körper die Proteine seinem Bedarf anpassen, auch wenn man klassisch acht als essenziell bezeichnet.3
Vorkommen
Vor allem Hülsenfrüchte enthalten viel Phenylalanin wie Sojabohnen (2122 mg/100 g) und Kindney-Bohnen (1220).1
| Lebensmittel | Protein g/100 g (USDA) | Phenylalanin mg/100 g (USDA) | %-Anteil Phenylalanin am Gesamtprotein |
| 36 g | 2122 mg | 5,8 % | |
| 30 g | 1733 mg | 5,7 % | |
| 25 g | 1132 mg | 4,6 % | |
| 23 g | 1130 mg | 5,1 % | |
| 15 g | 711 mg | 4,7 % | |
| Weizenvollkornmehl | 14 g | 646 mg | 4,7 % |
| 8 g | 410 mg | 5,2 % |
Nüsse, wie Erdnüsse (1400 mg/100 g) und Mandeln (1130) sowie Samen wie Leinsamen (960) und Sesam (940) sind sehr gute Quellen von Phenylalanin. Verschiedene Vollkorngetreide liefern ebenfalls hohe Mengen dieser Aminosäure. Auch Gemüse und Beeren enthalten etwa diese Menge, Früchte deutlich weniger.1
Sowohl Fleisch und Fisch als auch Eier (680 mg) und Milch (460 mg) enthalten weniger Phenylalanin als Sojabohnen, Kürbiskerne, Kichererbsen oder Mandeln.
Lager- und Zubereitungsverluste
Das Erhitzen der Speisen denaturiert Proteine und verändert damit deren Eigenschaften. Ein Beispiel ist das Spiegelei, das durch die Hitze in der Pfanne denaturiert. Beim Erhitzen das Ei verfestigen sich das flüssige Eigelb und das Eiklar, die Hauptproteinquelle. Die Proteine im Ei verdicken sich, ein Prozess, der als "Gerinnung" oder "Ausflocken" bekannt ist. Das Eiklar gerinnt bei 60 °C, das Eigelb bei 65 °C, und die vollständige Gerinnung erfolgt bei 70 °C.
Fleischproteine beginnen beim Kochen bei 40-60 °C bzw. 80 °C zu denaturieren.11 Die Oxidation von Aminosäuren durch reaktiven Sauerstoff kann ihre Funktion stark beeinträchtigen.
Ernährung - Gesundheit
Phenylalanin, das mehr als die Hälfte des Aspartam-Moleküls ausmacht, ist ein essenzieller Bestandteil von Körperproteinen und ein wichtiger Vorläufer vieler aromatischer Verbindungen, die für eine normale Körperfunktion notwendig sind.7
Essenziell bedeutet, dass unser Körper diese Aminosäuren nicht selbst herstellen (synthetisieren) kann, sie aber in gewissen Mengen benötigt, um das Wachstum und die Stickstoffbilanz aufrechtzuerhalten.10
Inzwischen weiss man, dass der Körper nur Lysin und Threonin irreversibel transaminiert und nur die zwei wirklich essenziell sind.3 Veganer erhalten Threonin im Durchschnitt etwa in der zweifachen Menge und sind mit Lysin gut abgedeckt. Spezielle Essgewohnheiten, z.B. Frutarier oder 80/10/10 oder noch extremer können mit der Zeit Mangel erreichen. Dies über lange Zeit ohne direkt erkennbare Symptome.
| Nicht nur Veganer oder Vegetarier sollten das Lesen: Veganer essen oft ungesund. Vermeidbare Ernährungsfehler. |
Tagesbedarf auf lange Sicht
Aus Phenylalanin bildet der Organismus die Aminosäure Tyrosin.3,5 Deshalb ist der Bedarf an Phenylalanin vom Tyrosingehalt der Nahrung abhängig. Der geschätzte mittlere Mindestbedarf an Phenylalanin bei Vorhandensein eines Überschusses an Tyrosin beträgt 9,1 mg/1 kg Körpergewicht pro Tag. Bei einer tyrosinfreien Diät beträgt der mittlere maximale Phenylalaninbedarf bei gesunden Erwachsenen durchschnittlich 42 mg pro 1 kg Körpergewicht pro Tag. Bei einem Verhältnis von Phenylalanin zu Tyrosin von 60:40 in der Nahrung erfolgt die Verwertung der beiden Aminosäuren optimal. Teilweise findet man auch Angaben zum zusammengefassten Bedarf (Phenylalanin und Tyrosin). Dieser beträgt 14 mg pro kg Körpergewicht pro Tag.5
Gemäss wissenschaftliche Tabellen Geigy, Bd.2, S. 232 beträgt der Tagesbedarf an Phenylalanin und Tyrosin zusammen 16 mg/kg Körpergewicht. Dies unter Einrechnung eines Zuschlags von 30 % für individuelle Schwankungen. Das wären für einen 75 kg schweren Menschen 1,2 g/Tag. Es gibt neuere Studien, die auch weniger empfehlen.
Ist Tyrosin im Überschuss vorhanden, benötigen wir rund 9,1 mg Phenylalanin pro kg Körpergewicht pro Tag. Bei einem Verhältnis von Phenylalanin zu Tyrosin von 60:40 erfolgt die Verwertung der beiden Aminosäuren optimal.5
Mangelerscheinungen bzw. Mangelsymptome
Bei einer ausgewogenen Ernährung tritt kaum ein Mangel an Phenylalanin auf. Eine natürliche vegane Ernährung deckt Phenylalanin mehr als gut ab. Säuglinge sind besonders gefährdet, wenn sie von Muttermilch zu früh entwöhnt sind und falsche Nahrung erhalten.
Ein durch manipulierte Ernährung verursachter Mangel an Tyrosin und Phenylalanin kann die Dopaminsynthese im Gehirn verringern und somit die Dopaminaktivität im Gehirn gesunder Menschen beeinträchtigen.13
Ein langanhaltender Mangel kann zu verringerter Leistungsfähigkeit, vermindertem Appetit und Stoffwechselstörungen führen. Die Krankheiten Kwashiorkor und Marasmus, die bei sehr langem Eiweiss- und allgemeinem Energiemangel auftreten können, sind in der westlichen Welt kaum noch zu finden.10
Überversorgung
Ein erhöhter Phenylalaninspiegel tritt auf, wenn der Abbau oder die Umwandlung in andere Substanzen gestört ist. Dies ist der Fall bei der genetisch bedingten Stoffwechselstörung Phenylketonurie (PKU), auch als Phenylalaninhydroxylase (PAH)-Mangel bekannt. Diese autosomal rezessiv vererbte Störung verhindert den vollständigen Abbau von Phenylalanin und führt zu einer Ansammlung von Phenylalanin im Blut.
Unbehandelt kann dies zu schwerer geistiger Behinderung, Epilepsie und Verhaltensstörungen führen. Die Prävalenz beträgt etwa 1:10.000 Neugeborenen weltweit. Menschen mit Phenylketonurie achten lebenslang auf eine phenylalaninarme Diät.
Ein auf Lebensmittelverpackungen aufgedruckter Hinweis "enthält eine Phenylalaninquelle" zeigt auf das Vorhandensein des Süssstoffs Aspartam, der während des Verdauungsvorganges Phenylalanin freisetzt.6
Bei chronischem Nierenversagen kann der Körper Phenylalanin nicht gut in Tyrosin umwandeln. Daher sind Tyrosin und das Verhältnis von Tyrosin zu Phenylalanin im Blut und in vielen Geweben niedriger, während die Phenylalaninspiegel normal oder leicht erhöht sind.8 Aus diesem Grund sollte man sich bei eingeschränkter Nierenfunktion eiweissarm ernähren, um eine vermehrte Produktion und Ansammlung von Harnstoff in der Niere durch Aminosäureabbau zu vermeiden. Aus dem Buch China Study kann man eindrücklich und mit guten Beweisen erkennen, dass wir normalerweise am Zuviel und nicht an Mangel an Proteinen leiden (siehe ausführliche Buchbesprechung): Erst seit ein paar Jahren entdeckten Wissenschaftler, dass tierisches Eiweiss, was als beste Proteinqualität (biologische Wertigkeit) galt, nicht die beste Gesundheit erzeugt, sondern das Gegenteil.
Funktionen im Körper
Phenylalanin weist folgende Funktionen im Körper auf:2,3,9,12
- Phenylalanin und davon abhängig Tyrosin tragen zur Synthese wichtiger körpereigener Proteine bei, wie die Neurotransmitter Adrenalin, Noradrenalin, Dopamin und Serotonon oder das Hautpigment Melanin und Hormon Thyroxin (T4). Phenylalanin kann die Gedächtnisleistung stärken und den Appetit zügeln.
- Anders als sonst bei Aminosäuren hat Phenylalanin nicht nur in seiner natürlichen L-Form, sondern auch als D-Form besondere Funktionen im Körper. Die Medizin verwendet synthetisch hergestelltes D- und L-Phenylalanin (DLPA), als Schmerzmittel oder gegen Depressionen. Die antidepressive Wirkung von L-Phenylalanin ist möglicherweise auf seine Vorläuferrolle bei der Synthese der Neurotransmitter Noradrenalin und Dopamin zurückzuführen.
Aufnahme und Stoffwechsel
Die Verdauung der mit der Nahrung aufgenommenen Proteine beginnt im Magen durch Pepsine. Sie spalten die Proteine in Peptide. Die weitere Spaltung in die einzelnen Aminosäuren geschieht im Dünndarm durch Peptidasen. Die Leber wandelt Phenylalanin in die nicht-essenzielle Aminosäure Tyrosin um, wenn die Tyrosinzufuhr über die Nahrung niedrig ist. Bei einer tyrosinarmen Ernährung kann der Körper bis zur Hälfte des aufgenommenen Phenylalanins in Tyrosin umwandeln. Umgekehrt sinkt bei einer tyrosinreichen Ernährung der Bedarf an Phenylalanin um 50 %.2,9
Speicherung - Verbrauch - Verluste
70-80 % der freien Aminosäuren befinden sich in der Skelettmuskulatur, ein geringerer Anteil im Blutplasma. Das zentrale Organ für die AS-Regulation ist die Leber. Dort erfolgt auch der Abbau, z.B. durch Desaminierung und Umsetzung zu Harnstoff, um zelltoxische Wirkungen zu verhindern.3
Strukturen
Phenylalanin ist eine chirale, aromatische α-Aminosäure mit hydrophober Seitenkette. Phenylalanin leitet sich strukturell vom Alanin ab und ist amphiphil.
Andere Bezeichnungen für L-Phenylalanin: 2-Amino-3-phenylpropionsäure; 2-Amino-3-phenylpropansäure. Summenformel: C9H11NO2. Abkürzungen: Phe, F (Einbuchstabencode).12
Literaturverzeichnis - 14 Quellen (Link zur Evidenz)
| 1. | US-Amerikanische Nährwertdatenbank USDA. |
| 2. | Kasper H, Burghardt W. Ernährungsmedizin und Diätetik. 11. Auflage. Elsevier GmbH. Urban & Fischer Verlag: München. 2009. |
| 3. | Biesalski HK, Grimm P. Taschenatlas der Ernährung. 6. Auflage. Georg Thieme Verlag: Stuttgart und New York. 2015. |
| 4. | WHO World Health Organization. Protein and amino acid requirements in human nutrition. Technical Report Series: 935. 2002. |
| 5. | Pencharz PB, Hsu JW et al. Aromatic amino acid requirements in healthy human subjects. J Nutr. 2007 Jun;137(6 Suppl 1):1576S-1578S; discussion 1597S-1598S. |
| 6. | Van Spronsen FJ, Blau N et al. Phenylketonuria. Nat Rev Dis Primers. 2021 May 20;7(1):36. |
| 7. | Harper AE. Phenylalanine metabolism. Aspartame. 2nd ed. CRC Press, 2020. 77-109. |
| 8. | Kopple JD. Phenylalanine and tyrosine metabolism in chronic kidney failure. J Nutr. 2007 Jun;137(6 Suppl 1):1586S-1590S; discussion 1597S-1598S. |
| 9. | Litwack G. Metabolism of Amino Acids. Human Biochemistry. 2018. |
| 10. | Watford M, Wu G. Protein. Adv Nutr. 2011 Jan;2(1):62-63. |
| 11. | Ishiwatari N, Fukuoka M et al. Effect of protein denaturation degree on texture and water state of cooked meat. J Food Eng. 2013;117(3):361-369. |
| 12. | Pubchem.ncbi.nlm.nih.gov. Phenylalanine. |
| 13. | Montgomery AJ, McTavish SF et al. Reduction of brain dopamine concentration with dietary tyrosine plus phenylalanine depletion: an [11C]raclopride PET study. Am J Psychiatry. 2003 Oct;160(10):1887-1889. |
| 14. | Ifst Institute of Food Science & Technology. Protein: Coagulation. 2017. |
Für diese weisse Bohnen mit Apfel, Birne und Bratkartoffeln weicht man davor Bohnen über Nacht in Wasser ein. Im Buch findet sich ein passender Löwenzahnsalat.
Das indische Toor Dal mit Straucherbsen, Kreuzkümmel und Chili gelingt leicht und schnell.
Dieses "Tailgate-Chili mit Borlotti-Bohnen" ist ein deftiges Gericht, das Sie nach Belieben einfach modifizieren können. Hier mit Maiskolben und Tomaten.
Die Cyanobakterien Spirulina (Pulver etc.) kann man praktisch nie roh kaufen. Wegen ihres blauen Farbstoffs zählte man sie früher zu den Blaualgen. Bio?
Sojagranulat besteht aus gemahlenen, entfetteten und erhitzten Sojabohnen - ist nie roh! Wegen Eiweissgehalt und Konsistenz gilt es als (bio?) Fleischersatz.
Bierhefe hat einen würzigen, leicht käseartigen Geschmack. Man verwendet sie zum Würzen oder als Käseersatz in Speisen. Sie ist bio aber kaum roh erhältlich.






Kommentare