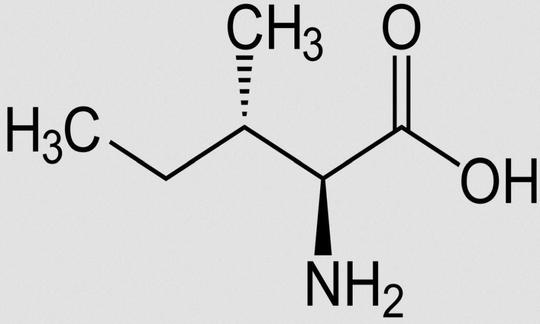
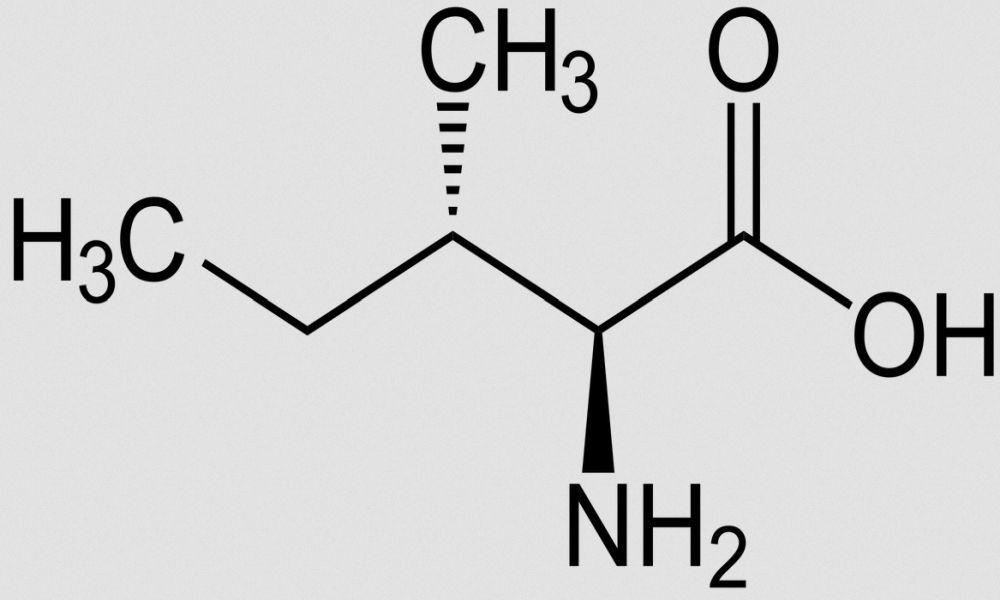
Isoleucin (Ile, I)
Ein Mangel an Isoleucin kann bei Kindern zu vermindertem Wachstum führen. Isoleucin ist wichtig für Muskelaufbau bis Hormonregulation – entdecken Sie im Beitrag die vielfältigen Funktionen von Isoleucin und was viel davon hat.
Die Versorgung mit Makro- und Mikronährstoffen ist bei einer ausgewogenen, pflanzenbasierten Ernährung mit wenig bis keinen industriell verarbeiteten Lebensmitteln in der Regel gegeben, mit Ausnahme von Vitamin B12. Doch vor allem sekundäre Pflanzenstoffe sind relevant für die Aufrechterhaltung der Gesundheit und Heilung von Krankheiten, obwohl sie nicht als essenzielle Nährstoffe gelten - ausser Vitamine.
---
Definition
Isoleucin (Ile, I) ist eine von acht (bei Kindern zehn, einschliesslich Histidin und Arginin) Aminosäuren, die für den menschlichen Organismus als essenziell (nicht entbehrlich) gelten. Der Mensch verwendet 21 proteinogene Aminosäuren. Das sind die Bestandteile der Proteine. Bis auf zwei (Lysin und Threonin) kann der Körper die Proteine seinem Bedarf anpassen, auch wenn man klassisch acht als essenziell bezeichnet.5
Vorkommen
Besonders reich an Isoleucin sind Hülsenfrüchte, Nüsse und Samen.
| Lebensmittel | Protein g/100 g (USDA) | Isoleucin mg/100 g | %-Anteil Isoleucin am Protein |
| 36 g | 2000 mg | 5,6 % | |
| Lupinenmehl | 38 g | 1700 mg | 5,3 % |
| 34 g | 1500 mg | 4,4 % | |
| Kürbiskerne, getrocknet | 30 g | 1300 mg | 4,3 % |
| 25 g | 1100 mg | 4,4 % | |
| 26 g | 1100 mg | 4,2 % | |
| 18 g | 900 mg | 5,0 % | |
| 17 g | 800 mg | 4,7 % |
Weitere Bohnen sind z.B. Kidney-Bohne (1000 mg/100 g) oder weisse Bohnen (1000). Bei Nüssen, Samen und Kernen sind zu nennen, Sonnenblumenkerne (1100), Cashewkerne (790), Sesam (760), Mandeln (750) und Walnuss (620), Amaranth (580), Dinkel (550), Buchweizen (500), Quinoa (500) und und Mais (340). Es gibt noch weitere Lebensmittel mit grösseren Mengen dieser Aminosäure.1
Einige grosse Lieferanten für Isoleucin, wie Spirulina (3200 mg), getrocknete Petersilie (1500 mg, frisch 120 mg), Senfpulver (1200 mg) oder Bockshornklee (1200 mg) und schwarzer Senf (1100 mg), sowie viele Gewürze, isst man in zu geringen Mengen. Deshalb führen wir sie in der Tabelle nicht auf. Sojabohnen und Lupinmehl haben etwa die doppelte Menge an Isoleucin als Rindfleisch (967 mg) und deutlich mehr als Hähnchenbrustfilet (1219 mg). Eier weisen 672 mg und Kuhmilch 198 mg auf, was ca. bzw. nur etwa 10 % des Gehalts von Soja- oder Lupinenmehl entspricht.1
Als Veganer müsste man sich schon sehr einseitig ernähren, um einen andauernden Eiweissmangel zu bekommen.
Lager- und Zubereitungsverluste
Das Erhitzen der Speisen denaturiert Proteine und verändert damit deren Eigenschaften. Ein Beispiel ist das Spiegelei, das durch die Hitze in der Pfanne denaturiert. Beim Erhitzen das Ei verfestigen sich das flüssige Eigelb und das Eiklar, die Hauptproteinquelle. Die Proteine im Ei verdicken sich, ein Prozess, der als "Gerinnung" oder "Ausflocken" bekannt ist. Das Eiklar gerinnt bei 60 °C, das Eigelb bei 65 °C, und die vollständige Gerinnung erfolgt bei 70 °C.8
Die Proteinoxidation einer Aminosäure durch Reaktive Sauerstoffspezies kann dessen Funktion erheblich beeinflussen.
Ernährung - Gesundheit
Verzweigtkettige Aminosäuren (Branched Chain Amino Acids, kurz BCAAs), bestehend aus Leucin, Isoleucin und Valin, sind essenzielle Aminosäuren. Sie spielen eine wichtige Rolle bei verschiedenen Prozessen im Körper, wie der Regulierung des Energiestoffwechsels, der Darmgesundheit, der Immunität sowie bei Krankheiten sowohl beim Menschen als auch bei Tieren.9
Unser Körper kann BCAAs nicht selbst herstellen (synthetisieren), benötigt sie aber in gewissen Mengen, um das Wachstum und die Stickstoffbilanz aufrechtzuerhalten. Etwa 35 % der unentbehrlichen Muskelproteine und 40 % der gesamten von Säugetieren benötigten Aminosäuren bestehen aus diesen BCAAs.10,11
Inzwischen weiss man, dass der Körper nur Lysin und Threonin irreversibel transaminiert und nur die zwei wirklich essenziell sind.5 Spezielle Essgewohnheiten, wie bei Frutariern (Fructarier, Frutaner, Fruganer) oder der 80/10/10 (High-Carb-Diät) und noch extremeren Diäten, können im Laufe der Zeit zu Mangelerscheinungen führen. Dies geschieht oft über lange Zeit ohne direkt erkennbare Symptome.
| Nicht nur Veganer oder Vegetarier sollten das Lesen: Veganer essen oft ungesund. Vermeidbare Ernährungsfehler. |
Tagesbedarf auf lange Sicht
Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene an Isoleucin reichen, je nach verwendeter Methode, von 7,5 bis 28 mg Isoleucin pro Kilogramm Körpergewicht. Die WHO gibt einen Tagesbedarf von 20 mg/kg Körpergewicht an.6 Allerdings beträgt der Mindestbedarf an Isoleucin inkl. 30 % Zuschlag für individuelle Schwankungen nach wissenschaftliche Tabellen Geigy, Bd.2, S. 232 nur 12 mg/kg Körpergewicht. Das wären für einen 75 kg schweren Menschen 0,9 g/Tag.
Das Bundesinstitut für Risikobewertung (BfR) gibt an, dass Erwachsene bis zu 2,2 g isoliertes Isoleucin (einzeln oder kombiniert) pro Tag zusätzlich zur normalen Nahrungszufuhr tolerieren können. Die aktuellen Studienergebnisse sprechen auch dafür, verzweigtkettige Aminosäuren nicht einzeln, sondern in Kombination einzunehmen. Zudem empfiehlt das BfR für Kinder, Jugendliche, Schwangere und Stillende, auf isolierte Zufuhren von verzweigtkettigen Aminosäuren aus Nahrungsergänzungsmitteln oder Sportlernahrung zu verzichten.12
Mangelerscheinungen bzw. Mangelsymptome
Ein Mangel an Isoleucin ist bei ungenügender Zufuhr über die Nahrung mit langer Dauer möglich. Eine natürliche vegane Ernährung deckt Isoleucin mehr als gut ab und bei mehr Muskelarbeit isst man auch mehr. Säuglinge sind besonders gefährdet, wenn sie von Muttermilch zu früh entwöhnt sind und falsche Nahrung erhalten.
Die bei sehr lang andauerndem Eiweiss- und generellem Energiemangel entstehenden Krankheiten Kwashiorkor und Marasmus findet man in der westlichen Welt kaum mehr. Leichtere Mangelerscheinungen können bei Kindern zu vermindertem Wachstum und bei Erwachsenen zum Verlust fettfreier Körpermasse führen.11
Ein Mangel macht sich zuerst als allgemeine Leistungsschwäche auf körperlicher und geistiger Ebene, Hormonschwankungen und Krankheitsanfälligkeit bemerkbar.
Überversorgung
Eine Isoleucinüberversorgung tritt nur bei hoher Zufuhr dieser Aminosäure auf. Dies ist über die Ernährung allein kaum möglich. Betroffen sind daher im Grunde nur Menschen, die Isoleucin isoliert über Ergänzungsmittel aufnehmen beziehungsweise überdosieren.
Der Überschuss an BCAAs kann die Aufnahme anderer neutraler Aminosäuren wie Phenylalanin, Tyrosin, Histidin und Tryptophan, die Vorläufer von Dopamin, Noradrenalin, Histamin und Serotonin sind, im Gehirn verringern, da sie über einen gemeinsamen Transporter für grosse neutrale Aminosäuren ins Gehirn gelangen.13
Bei eingeschränkter Nierenfunktion sollte man sich eiweissarm ernähren, um eine vermehrte Produktion und Ansammlung von Harnstoff in der Niere durch Aminosäureabbau zu vermeiden. Aus dem Buch China Study kann man eindrücklich und mit guten Beweisen erkennen, dass wir normalerweise am Zuviel und nicht an Mangel an Proteinen leiden (siehe ausführliche Buchbesprechung): Erst seit ein paar Jahren entdeckten Wissenschaftler, dass tierisches Eiweiss, was als beste Proteinqualität (biologische Wertigkeit) galt, nicht die beste Gesundheit erzeugt, sondern das Gegenteil.
Funktionen im Körper
Isoleucin trägt zur Energiegewinnung, zum Muskelaufbau, zur Regulation des Blutzuckerspiegels und zur Wundheilung bei.2,3,4,5
- Besondere Bedeutung hat Isoleucin beim Aufbau und dem Schutz der Muskulatur.
- Bei starker körperlicher Anstrengung kann Isoleucin als Energielieferant dienen, sobald die freien Glukosereserven des Organismus aufgebraucht sind. Dieser Stoffwechsel führt über mehrere Zwischenstufen zur Glukoneogenese (Glukoseneubildung). Der Abbau von Isoleucin liefert Acetyl-CoA und Succinyl-CoA. Aber auch bei geringer körperlicher Belastung ist eine ausreichende Isoleucin-Zufuhr wichtig, da die Aminosäure für den Erhalt und die regelmässige Regeneration der Muskelgewebe laufend nötig ist.
- Isoleucin reguliert zahlreiche Hormone, darunter das Wachstumshormon Somatotropin und Insulinum.
- Durch seine stärkende Wirkung auf das Immunsystem und den Beitrag zur Bildung von neuem Gewebe spielt Isoleucin eine entscheidende Rolle bei der Abwehr von Krankheitserregern und der Wundheilung.
Aufnahme und Stoffwechsel
Der Stoffwechsel von BCAAs erfolgt in zwei Hauptschritten, die in Muskel und Leber unterschiedlich ausgeprägt sind. Im Muskel findet im ersten Schritt eine reversible Transaminierung von BCAAs zu den entsprechenden α-Ketosäuren statt. Zum vollständigen Abbau der BCAAs müssen die α-Ketosäuren in die Leber gelangen, wo sie weiter oxidieren.12,15
Im zweiten Schritt erfolgt eine irreversible oxidative Decarboxylierung durch den verzweigtkettigen Keto-Säure-Dehydrogenase-Komplex. Die Enzymaktivität ist beim Menschen in Leber, Nieren und Gehirn hoch und in Skelettmuskulatur, Darm und Fettgewebe niedrig. Im weiteren Verlauf des Abbaus entsteht aus Isoleucin Acetyl-CoA und Succinyl-CoA. Hierbei wirkt Isoleucin sowohl als glykogene als auch als ketogene Aminosäure.
Bei der initialen Transaminierung entsteht durch Übertragung der Stickstoffgruppe auf α-Ketoglutarat Glutaminsäure. Neben der Proteinsynthese und als Energiesubstrat dienen BCAA im Gehirn und im peripheren Gewebe als Stickstoffdonatoren. So sind BCAA, vor allem Leucin, wichtige Stickstoffquellen für die Synthese der Neurotransmitter Glutamat und γ-Aminobuttersäure im Gehirn.12,15
Speicherung - Verbrauch - Verluste
Die Hauptquelle für BCAAs ist die Ernährung, während die Synthese durch die Darmmikrobiota nur einen kleinen Teil ausmacht. BCAAs aus der Nahrung oder dem Proteinabbau gelangen in den Blutkreislauf und von dort in die Gewebe. Dort oxidieren sie oder bauen sich in neues Protein ein. Der Normwert für freies Isoleucin im Blut beträgt 7 mg/l.
Im menschlichen Organismus kommt Isoleucin fast nur in gebundenem Zustand vor. In der Muskulatur ist der Isoleucingehalt besonders hoch. Der Verlust von BCAAs erfolgt hauptsächlich durch oxidativen Abbau. Über den Urin verlieren wir normalerweise pro Tag 10 bis 15 mg Isoleucin.7,16
Strukturen
Isoleucin ist eine proteinogene α-Aminosäure mit einer hydrophoben Seitenkette. Als Leucine bezeichnet man die Zusammenfassung der vier isomeren Aminosäuren Leucin, Isoleucin, tert-Leucin und Norleucin.
Andere Bezeichnungen für Isoleucin: α-Amino-β-methylvaleriansäure; (2S,3S)-2-Amino-3-methyl-pentansäure. Summenformel: C6H13NO2. Abkürzungen: Ile, I (Einbuchstabencode).14
Literaturverzeichnis - 16 Quellen
| 1. | US-Amerikanische Nährwertdatenbank USDA. |
| 2. | Elmadfa I, Leitzmann C. Ernährung des Menschen. 5. Auflage. Verlag Eugen Ulmer: Stuttgart. 2015. |
| 3. | De Groot H, Farhadi J. Ernährungswissenschaft. 6. Auflage. Verlag Europa-Lehrmittel: Haan-Gruiten. 2015. |
| 4. | Kasper H, Burghardt W. Ernährungsmedizin und Diätetik. 11. Auflage. Elsevier GmbH, Urban & Fischer Verlag: München. 2009. |
| 5. | Biesalski HK, Grimm P. Taschenatlas der Ernährung. 6. Auflage. Georg Thieme Verlag: Stuttgart und New York. 2015. |
| 6. | WHO World Health Organization. Protein and amino acid requirements in human nutrition. Technical Report Series: 935. 2002. |
| 7. | Roche Lexikon Medizin. 5. Auflage. Urban & Fischer Verlag, Elsevier: München. 2003. |
| 8. | Ifst Institute of Food Science & Technology. Protein: Coagulation. 2017. |
| 9. | Nie C, He T et al. Branched Chain Amino Acids: Beyond Nutrition Metabolism. Int J Mol Sci. 2018 Mar 23;19(4):954. |
| 10. | Tamanna N, Mahmood N. Emerging Roles of Branched-Chain Amino Acid Supplementation in Human Diseases. Int Sch Res Notices. 2014 Nov 12;2014:235619. |
| 11. | Watford M, Wu G. Protein. Adv Nutr. 2011 Jan;2(1):62-63. |
| 12. | BfR Bundesinstitut für Risikobewertung. Nahrungsergänzungsmittel - Isolierte verzweigtkettige Aminosäuren können bei hoher Aufnahme die Gesundheit beeinträchtigen. 20/2019. |
| 13. | Holeček M. Side effects of amino acid supplements. Physiol Res. 2022 Mar 25;71(1):29-45. |
| 14. | Kim WK, Singh AK et al. Functional role of branched chain amino acids in poultry: a review. Poult Sci. 2022 May;101(5):101715. |
| 15. | Holeček M. The role of skeletal muscle in the pathogenesis of altered concentrations of branched-chain amino acids (valine, leucine, and isoleucine) in liver cirrhosis, diabetes, and other diseases. Physiol Res. 2021 Jul 12;70(3):293-305. |
| 16. | Neinast M, Murashige D et al. Branched Chain Amino Acids. Annu Rev Physiol. 2019 Feb 10;81:139-164. |
Für diese weisse Bohnen mit Apfel, Birne und Bratkartoffeln weicht man davor Bohnen über Nacht in Wasser ein. Im Buch findet sich ein passender Löwenzahnsalat.
Dieses "Tailgate-Chili mit Borlotti-Bohnen" ist ein deftiges Gericht, das Sie nach Belieben einfach modifizieren können. Hier mit Maiskolben und Tomaten.
Geräucherte Cashew-Croquetas, serviert mit in Portwein glasierter Roter Bete und aromatischer Orangenemulsion, sind leckere und vegane spanische Tapas mit Panko
Die Cyanobakterien Spirulina (Pulver etc.) kann man praktisch nie roh kaufen. Wegen ihres blauen Farbstoffs zählte man sie früher zu den Blaualgen. Bio?
Bierhefe hat einen würzigen, leicht käseartigen Geschmack. Man verwendet sie zum Würzen oder als Käseersatz in Speisen. Sie ist bio aber kaum roh erhältlich.
Sojagranulat besteht aus gemahlenen, entfetteten und erhitzten Sojabohnen - ist nie roh! Wegen Eiweissgehalt und Konsistenz gilt es als (bio?) Fleischersatz.





Kommentare