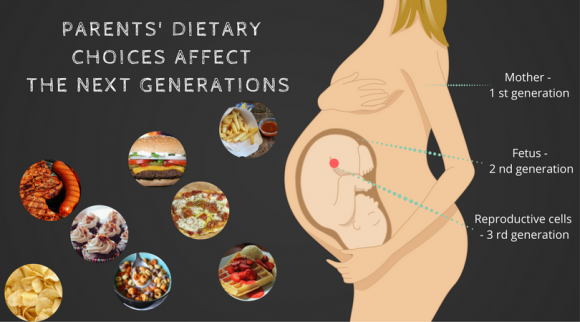
Stile di vita dei genitori e loro effetto sui bambini
La dieta e lo stile di vita dei genitori influenzano epigeneticamente i bambini non ancora nati. Sottovalutiamo l'effetto dell'epigenetica.
Sommario
- Conclusioni
- 1. La dieta dei genitori influenza la salute e il benessere dei loro figli
- 2. Perché succede?
- 3. Programmazione metabolica fetale
- 4. Cosa succede a livello cellulare?
- 5. L' epigenetica è il principale processo di programmazione metabolica fetale
- 7. In che modo il tuo stile di vita può influire sulla salute dei tuoi figli
- Bibliografia
Conclusioni
La programmazione nutrizionale o " Programmazione nutrizionale " spiega perché alcune persone hanno una predisposizione a soffrire di determinate malattie da adulti. Il motivo principale è che c'è stato qualche disturbo dello sviluppo durante la fase fetale o nella prima infanzia.
Secondo al paradigma Barker, "origini dello sviluppo di salute e malattia" ( "Developmental Origins of Health and Disease"), le condizioni durante periconcepción (2 o 3 mesi prima della gravidanza) e la gravidanza e fase dell'allattamento al seno) hanno una grande influenza su di noi. Un ambiente sfavorevole provoca la predisposizione ad alcune malattie (specialmente infiammatorie) che si manifestano in età adulta. 1
Sia l'eccesso di cibo che la malnutrizione sono fattori importanti che contribuiscono alla creazione di un ambiente dannoso per il nascituro. Sono direttamente correlati a condizioni metaboliche, come ipertensione, insulino-resistenza, iperlipemia e obesità addominale. 2
Se l'ambiente è dannoso, l'embrione, il feto o il neonato vengono adattati per sopravvivere a queste condizioni avverse. Questi cambiamenti influenzano le funzioni corporee, il rimodellamento dei tessuti e l'attivazione o il silenziamento di alcuni geni. Tali cambiamenti possono esistere o rimanere attivi, anche se gli stimoli negativi sono scomparsi.
La malnutrizione durante la gravidanza e la prima infanzia può aumentare il rischio di obesità, diabete, sindrome metabolica e malattie cardiovascolari in età adulta. Soprattutto, se non si segue un'alimentazione sana e non si svolge un'attività fisica regolare. 3
Un breve glossario
Embrione : dopo che lo sperma ha fecondato l'uovo (zigote), inizia a dividersi fino a quando non diventa una palla di cellule (blastocisti) e si sposta nell'utero. Lì, una parte delle cellule forma la placenta, mentre l'embrione si sviluppa dall'altra. In questa fase si formano la maggior parte degli organi interni e della struttura corporea. Lo sviluppo del cervello e del midollo spinale avviene durante la gravidanza. Nuove cellule cerebrali si sviluppano durante la gravidanza e il primo anno dopo la nascita.
Feto : a partire dall'ottava settimana dopo la fecondazione, l'embrione viene chiamato feto.
Placenta: è l'organo che si forma nel grembo materno e che collega il feto con la madre. I nutrienti e l'ossigeno vengono trasmessi attraverso la placenta. Aiuta a eliminare i rifiuti dal sangue del bambino e combattere le infezioni.
Gravidanza / concepimento : periodo tra concepimento e parto, in cui l'embrione (e, successivamente, il feto) si sviluppa nel grembo materno.
1. La dieta dei genitori influenza la salute e il benessere dei loro figli
È qualcosa di ben noto e accettato da molti laici e scienziati che il cibo e lo stile di vita hanno un impatto diretto sulla salute.
Nuovi studi 3 mostrano che le abitudini alimentari personali e l'attività fisica determinano la salute e il benessere di una persona attraverso:
- L'ambiente in cui una persona si sviluppa nella fase fetale (accesso ai nutrienti, equilibrio ormonale e livello di stress della madre, placenta).
- La dieta dei genitori
In altre parole, le cattive abitudini influenzano non solo la persona che le esegue, ma anche i loro figli.
A breve termine, tutti questi cambiamenti influenzano lo sviluppo del cervello del bambino, la crescita, la struttura corporea e il metabolismo. A lungo termine, altera le capacità cognitive del bambino, l'immunità e il livello di energia, che influenzano le prestazioni scolastiche, il livello di apprendimento, nonché la capacità di svolgere un lavoro con successo e godere di una buona salute. 5
Barker paradigma sviluppato nel 1990 "Le origini dello sviluppo di salute e malattia" (origini dello sviluppo di salute e malattia), con la stessa idea. Indica che le condizioni prima della gravidanza (periconcezione), durante la gravidanza e l'allattamento sono decisive per la persona in via di sviluppo. In alcuni casi, se l'ambiente è sfavorevole, il bambino è suscettibile a determinate malattie da adulto (predisposizione). 1
2. Perché succede?
Già nelle prime fasi di sviluppo (fase embrionale e fase fetale) l'organismo può reagire ai fattori scatenanti dell'ambiente a livello cellulare, molecolare e biochimico. Se alcuni fattori di stress o stimoli dietetici inducono queste reazioni, i cambiamenti nel corpo rimangono anche quando lo stimolo che li ha provocati è scomparso. 6
Studi sugli animali sono stati condotti in due diversi scenari:
- L'allattamento eccessivo della madre con una dieta ricca di grassi, colesterolo alto e proteine, che ha portato all'obesità materna.
- Malnutrizione della madre a causa della mancanza di micronutrienti (calcio, ferro, sodio e zinco) e macronutrienti, come le proteine.
Gli animali che sono nati a basso peso hanno ricevuto una dieta ricca di calorie e, in seguito, da adulti, hanno avuto un aumento maggiore del grasso corporeo. Nella fase fetale, il corpo è stato programmato per limitare il dispendio energetico come risposta adattativa alle carenze. 7
Un altro studio 6 ha dimostrato che una dieta povera di proteine e povera di calorie durante la gravidanza provoca alterazioni nelle isole pancreatiche, come una ridotta vascolarizzazione o problemi nella generazione di cellule beta. Inoltre, c'è una diminuzione della sensibilità all'insulina nei muscoli. Sebbene il bambino segua una dieta normale dopo il parto e durante la sua infanzia, le alterazioni che si sono verificate negli organi sono irreversibili e aumentano la predisposizione ad avere il diabete e la sindrome metabolica.
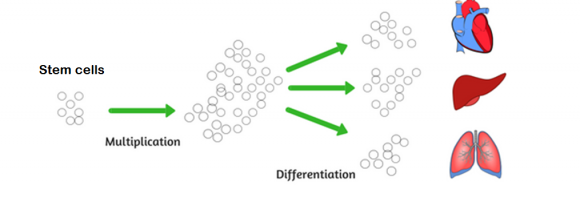
Tenendo conto del fatto che la plasticità (la capacità delle cellule di trasformarsi in altri tipi di cellule) è una delle principali caratteristiche delle cellule durante le fasi embrionali e fetali e cioè quando gli organi si sviluppano e strutturano, l'effetto di I fattori dannosi durante questo periodo sono più grandi che mai.
3. Programmazione metabolica fetale
La programmazione nutrizionale (metabolica) è il processo attraverso il quale la qualità e la quantità di nutrienti consumate durante la gravidanza hanno effetti duraturi sullo sviluppo del feto.
Ricerche ed esperimenti recenti sono stati condotti solo su animali (ratti e pecore). Sono stati sovralimentati o hanno ridotto la quantità di nutrienti per vedere quali effetti queste situazioni hanno avuto sulla loro prole. Con gli esseri umani è stato possibile solo effettuare studi epidemiologici. Esiste una relazione tra le condizioni durante la gravidanza e i problemi di salute che le persone sviluppano in età adulta.
Perché la programmazione metabolica fetale non è stata sperimentata nell'uomo
La " programmazione metabolica " viene eseguita, nella maggior parte dei casi, nelle fasi embrionali e fetali, quando la plasticità cellulare è maggiore. Per studiare le cellule embrionali e gli effetti dell'ambiente su di esse, i ricercatori devono generarle mediante fecondazione in vitro, qualcosa che provoca obiezioni di natura etica, morale, religiosa e legale.
La maggior parte delle ricerche sperimentali con animali che hanno modificato le condizioni esterne e studiato le conseguenze negli animali neonati e adulti non possono essere riprodotte nell'uomo.
I motivi per cui gli studi sugli animali in questo campo sono così rilevanti sono i seguenti: 8
- I geni di ratti, topi e persone sono simili al 99%.
- L'ambiente è facile da controllare.
- Il ciclo di vita è breve e, pertanto, è possibile analizzare i cambiamenti.
La qualità e la quantità di sostanze nutritive che la madre consuma durante la gravidanza può causare cambiamenti significativi nella struttura del cervello, dei reni e del cuore dei suoi figli. Ciò è associato a un rischio maggiore di malattie coronariche e disturbi dell'insulino-resistenza. 7
4. Cosa succede a livello cellulare?
Lo sviluppo umano nell'utero si basa su due processi principali: divisione cellulare e differenziazione cellulare (specializzazione). All'inizio, c'è un gruppo di cellule staminali, che possono diventare qualsiasi organo e tessuto nel corpo. Queste cellule si riproducono e si specializzano nelle proprietà di un organo specifico. Il momento in cui avvengono questi processi varia a seconda dell'organo. Ad esempio, il cuore si forma prima che gli organi riproduttivi e i polmoni inizino a svilupparsi nelle ultime settimane di gravidanza.
I cambiamenti nella dieta della madre possono influenzare la divisione cellulare e il processo di differenziazione. Se si verificano condizioni indesiderate durante la proliferazione (divisione cellulare), possono causare, ad esempio, che un organo rimanga più piccolo, ma con normali proprietà cellulari. Condizioni sfavorevoli durante la differenziazione possono causare dimensioni normali del tessuto, ma con forma e funzionalità diverse. 7
Diversi studi hanno dimostrato che, nella maggior parte dei casi, se la madre non si nutre bene durante la gravidanza, si verificano alterazioni nei seguenti organi:
- Reni: gli animali esposti a carenze nutrizionali nella fase fetale hanno tra il 30 e il 40% in meno di nefroni rispetto al normale. 7 Studi condotti sull'uomo mostrano che la popolazione aborigena australiana ha il 20% in più di probabilità di soffrire di insufficienza renale cronica rispetto alla popolazione caucasica. 9
- Cervello: studi di ricerca condotti con ratti stabiliscono che la malnutrizione riduce la densità dei capillari nel cervello e quella dei neuroni responsabili della regolazione dell'appetito. 10
- Pancreas : a causa del ridotto apporto nutrizionale, le cellule pancreatiche dell'animale hanno meno isolotti di Langerhans e l'afflusso di sangue è ridotto. 7
Possiamo contare sulla crescita fetale per misurare la salute futura del bambino?
Fino ad ora, la crescita fetale (peso e dimensioni) è stata uno degli argomenti più studiati per dimostrare la relazione tra condizioni ambientali, sviluppo fetale e salute nella vita adulta.
Gli studi pubblicati da Barker e dai suoi colleghi dopo aver osservato migliaia di persone nate per un periodo di vent'anni hanno dimostrato quanto segue: un peso alla nascita ridotto è considerato un segno (prognosi) di alta pressione sanguigna, alto rischio di coagulazione , intolleranza al glucosio, diabete di tipo 2 e sindrome metabolica. 7
Altri fattori che predicono le future condizioni di salute sono: ridotta circonferenza della vita, dimensioni della testa grandi e peso ridotto in relazione alla lunghezza del corpo.
Le ricerche di Rosenboom 11 sulla carestia olandese e le conseguenze che ha avuto sui bambini nati in quel momento dimostrano chiaramente che la malnutrizione durante la gravidanza influenza la salute del bambino quando diventa adulto.
D'altra parte, gli studi sugli animali mostrano che le ripercussioni dell'ambiente vanno oltre lo sviluppo fetale. Ma poiché questo è meno ovvio ed espresso a diversi livelli, è difficile osservarlo sperimentalmente.
Anche quando il feto si sviluppa senza problemi, la mancanza di nutrienti può avere un impatto importante sulla salute futura. Pertanto, il peso alla nascita potrebbe non essere l'unica cosa che predice la salute di quella persona in età adulta.
Dopo aver osservato i bambini nati durante e dopo la carestia olandese, Rosenboom ha concluso che la malnutrizione della madre durante la gravidanza può influire sulla salute del bambino nel tempo. 10 Inoltre, gli effetti della malnutrizione dipendono dal tempo della gravidanza e dalla gamma di sviluppo di organi e sistemi.
Ad esempio, ogni bambino che è stato concepito prima della carestia olandese e che ha sofferto di malnutrizione durante l'ultima parte della gravidanza, da adulto aveva un rischio maggiore di avere insulino-resistenza e ridotta tolleranza al glucosio. Coloro che sono stati concepiti durante la carestia olandese avevano un rischio maggiore di avere il colesterolo alto e soffrire di malattie coronariche in età adulta. 11
Le variazioni nella dieta della madre sono i migliori predittori di cambiamenti fetali e l'asse principale della programmazione fetale. Ovviamente, ci sono molti altri fattori che influenzano anche la nutrizione del feto, come la composizione corporea della madre, la sua età, l'attività corporea che svolge, il flusso sanguigno della placenta, se la trasmissione di nutrienti ha successo, l'equilibrio ormone della madre, ecc.
5. L' epigenetica è il principale processo di programmazione metabolica fetale
L'alimentazione della madre colpisce il feto attraverso alterazioni durante la divisione e la differenziazione cellulare, nonché nell'espressione genica del feto (processi epigenetici).
Come funziona l'epigenetica
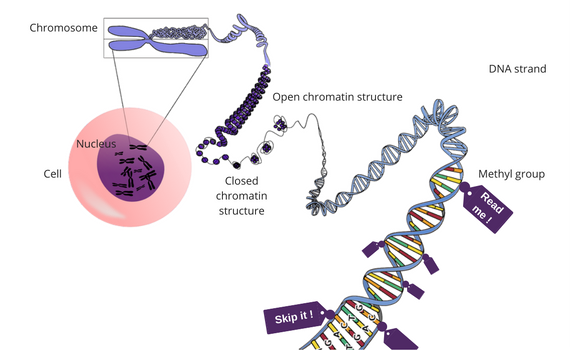
Immagina il corpo umano come una fabbrica enorme e complessa, in cui le cellule sono le unità di base del lavoro. Per sapere come funziona tutto, le celle hanno bisogno di informazioni, regole e procedure di base. Quel gigantesco database che contiene le regole e le procedure si trova nel DNA, dove tutto è organizzato con cura in sequenze di informazioni chiamate geni. Esistono oltre 20.000 geni e tutte le cellule hanno accesso a tutti loro, sebbene non tutte le informazioni siano "lette" o implementate. Le informazioni vengono recuperate e utilizzate in modo selettivo seguendo le istruzioni chiamate marcatori epigenetici. Tutti questi marcatori epigenetici formano l'epigenoma, che è unico in ogni persona ed è fortemente influenzato dall'ambiente. Di seguito puoi leggere di più sulla differenza tra genetica ed epigenetica.
L'epigenetica (secondo l'articolo di Wikipedia : dal greco epi, in o on, e -genetica) è l'accentuazione o la definizione di alcune parti di quelle regole e procedure, rendendole "attivamente" visibili, attirando l'attenzione delle cellule su di esse e ordinando loro di esprimere quelle sezioni. Altri fattori epigenetici disattivano determinati geni e li rendono inaccessibili, in modo che le cellule non possano leggere o utilizzare tali informazioni.
Principali meccanismi di alterazioni epigenetiche
I principali meccanismi coinvolti nei cambiamenti epigenetici sono: 12
- Metilazione : un gruppo metilico (composto chimico) legato al DNA e che modifica la funzione di un gene specifico.
- Modifica dell'istone : per realizzarlo, la lunga catena del DNA deve essere arrotolata nelle strutture proteiche, negli istoni. In questo modo si forma una struttura di cromatina. Se è troppo stretto, le celle non possono leggere le informazioni in quella sequenza. Se è un po 'allentato, le informazioni possono essere lette e utilizzate.
In un esperimento, un gruppo di pecore ha ricevuto una dieta durante le 8 settimane precedenti al concepimento e durante le prime 6 settimane di gravidanza in cui le quantità di gruppi metilici, acido folico, vitamina B 12 e metionina erano carenti. La progenie maschile di queste pecore era resistente all'insulina e aveva la pressione alta. 13
Questo fenomeno si osserva meglio in gemelli identici che vivono in ambienti diversi. Anche se hanno lo stesso genoma (le informazioni ereditate), il loro corpo funziona in modo diverso e la loro salute non è la stessa.
Epigenetica: il buono e il cattivo
Lo scopo dell'epigenetica è aiutare il corpo a superare i grandi cambiamenti dell'ambiente e della vita. Ad esempio, aiuta il corpo a sopravvivere durante i periodi di carestia, il corpo femminile durante la gravidanza e il corpo dei giovani a cambiare durante la pubertà.
I problemi iniziano quando quei cambiamenti epigenetici iniziano a generare malattie. A volte, i geni attivi sono quelli associati a determinate malattie. Ad esempio, il cancro può verificarsi a causa dell'attivazione di troppi geni che promuovono la crescita o, al contrario, la cancellazione di geni che eliminano i tumori.
I cambiamenti epigenetici sono ereditari
È molto importante tenere presente che questi marcatori epigenetici non sono fissi. Possono cambiare nel corso della vita, influenzati, ad esempio, dal cibo e dall'ambiente. Alcuni possono persino essere ereditati dalle generazioni passate e trasmessi ai seguenti.
In un esperimento condotto dal Center for Reproductive Biology presso la Washington State University, le femmine di ratto incinta sono state esposte a livelli relativamente alti di metossicloro (insetticida) e vinclozolina (fungicida). Di conseguenza, la progenie maschile ha mostrato una diminuzione della produzione di spermatozoi e un tasso più elevato di infertilità. Lo studio di ricerca ha dimostrato che la causa di queste manifestazioni era un processo di metilazione che colpiva due geni. Successivamente, sono state osservate le successive quattro generazioni, ma non è stato somministrato né insetticida né fungicida. Il 90% dei ratti maschi ha mostrato gli stessi effetti negativi. 14
Una ricerca della dott.ssa Erica Watson dell'Università di Cambridge mostra che: se la nonna materna o il nonno materno manifesta una specifica mutazione genetica (nota come mutazione MTRR), provoca una carenza di acido folico, sebbene i loro nipoti (geneticamente normali ) non hanno ereditato questa mutazione genetica, sono esposti al rischio di alcuni disturbi dello sviluppo. 16
7. In che modo il tuo stile di vita può influire sulla salute dei tuoi figli
Per molto tempo, gli scienziati hanno sostenuto che la malnutrizione e le malattie occidentali si escludono a vicenda. Sorprendentemente, gli esperimenti in cui è stata limitata l'assunzione nutrizionale di animali in gravidanza mostrano gli stessi risultati degli esperimenti in cui gli animali sono stati sovralimentati: pressione sanguigna più alta, intolleranza al glucosio, resistenza all'insulina e una maggiore predisposizione all'obesità. 17
Questi sono gli effetti più importanti che la dieta, il peso e lo stile di vita dei genitori possono avere sui bambini prima e dopo il concepimento:
| Cibo e stile di vita dei genitori | Possibile effetto sulla prole |
| Dieta ricca di grassi | Aumento della pressione sanguigna, malattia vascolare ( disfunzione endoteliale ) 18 |
| Dieta ricca di proteine | Consumo energetico ridotto, obesità 19 |
| Livelli elevati di colesterolo nella madre durante la prima fase della gravidanza | Sovrappeso / obesità, aumento del grasso corporeo, aumento dei livelli di colesterolo a 4 anni 23 |
| Malnutrizione della madre durante la gravidanza | Aumento della produzione di glucosio nel fegato, alterazione dell'ossidazione degli acidi grassi, resistenza dei chetoni, variazioni dell'assorbimento del glucosio 2 |
| Sovralimentazione della madre | Obesità, intolleranza al glucosio, alterazione dell'appetito nel cervello |
| Dieta povera di proteine | L'espressione di 102 geni nell'ipotalamo e 36 geni nei reni viene modificata 20 |
| Obesità della madre prima e durante la gravidanza e alto livello di leptina (a causa dell'obesità) | Alto livello di leptina (a causa dell'obesità) durante lo sviluppo dell'ipotalamo del feto, che porta alla resistenza alla leptina, all'iperfagia e alla ridotta capacità del bambino di regolare il suo appetito 21 Aumento della pressione sanguigna, aumento della tendenza all'obesità e all'insulino-resistenza 1 |
| Sovrappeso prima della gravidanza | Aumento della pressione sanguigna, aumento della tendenza all'obesità e all'insulino-resistenza 22 |
| Dieta povera di ferro della madre prima e durante la gravidanza | Alterazioni nello sviluppo del cuore nella fase fetale, che possono causare un aumento della pressione sanguigna e cambiamenti nel metabolismo degli acidi grassi 7 |
| Il padre inizia a fumare presto | Aumento dell'indice di massa corporea dei bambini (maschio) 23 |
| Consumo di alcol del padre prima del concepimento | Riduzione del peso alla nascita, ritardo dello sviluppo, problemi di immunità, disturbi comportamentali, iperattività e riduzione delle prestazioni 24 |
La gravità di questi effetti dipende dalla durata dell'esposizione a sostanze nocive, dalla loro quantità e dal tempo di sviluppo in cui si verifica questa esposizione.
Fino a poco tempo fa, gli scienziati credevano che i marcatori epigenetici che influenzano i geni del feto avessero un effetto duraturo sulla loro salute e benessere. Nuovi studi indagano se questi marker epigenetici rimangano flessibili in età adulta. Ciò sarebbe possibile se le condizioni ambientali cambiassero favorevolmente.
Ogni persona è responsabile dei propri geni, Gottfried Schatz
In altre parole, anche se le modificazioni epigenetiche si sono verificate durante la fase fetale e le condizioni di salute sono cambiate per l'età adulta, sarebbe possibile alterare o addirittura invertire il suo effetto in età adulta. L'esposizione costante a stimoli ambientali positivi (ad esempio una dieta e uno stile di vita sani, emozioni positive) può alterare l'attivazione e la disattivazione dei geni e prevenire malattie come cancro, diabete, ipertensione e altri problemi cardiovascolari.
Tutte queste informazioni rimangono speculative. Tuttavia, vi è una crescente ricerca sulle modificazioni epigenetiche, sulla programmazione metabolica e sugli effetti che la dieta dei genitori, nonché le decisioni che determinano il loro stile di vita, hanno sui loro figli.
Fonti
24 fonti
- Tarrade A, Panchenko P, Junien C, Gabory A. Placental contribution to nutritional programming of health and diseases: epigenetics and sexual dimorphism. Journal of Experimental Biology 2015.
- Martínez JA, Cordero P, Campión J, Milagro FI. Interplay of early life nutritional programming on obesity, inflammation and epigenetic outcomes. Proc Nutr Soc. 2012 May;71(2):276-83.
- Wadhwa PD, Buss C, Entringer S, Swanson JM. Developmental Origins of Health and Disease: Brief History of the Approach and Current Focus on Epigenetic Mechanisms. Seminars in reproductive medicine. 2009;27(5):358-368. doi:10.1055/s-0029-1237424.
- Vickers, MV. Early Life Nutrition, Epigenetics and Programming of Later Life Disease. Nutrients 2014.
- Uauy R, Kain J, Corvalan C. How can the Developmental Origins of Health and Disease (DOHaD) hypothesis contribute to improving health in developing countries? The American journal of clinical nutrition. 2011.
- Patel MS, Srinivasan M. Metabolic Programming: Causes and Consequences. The Journal of Biological Chemistry, January 2011; 277.
- Langley-Evans SC. Nutritional programming of disease: unravelling the mechanism. Journal of Anatomy. 2009;215(1):36-51.
- Gunter C, Dhand R. Human biology by proxy. Nature 420, 509, 5 December 2002.
- Singh GR, Hoy WE. Kidney volume, blood pressure, and albuminuria: findings in an Australian aboriginal community. J Kidney Dis. 2004.
- Plagemann A, Harder T, Rake A, et all. Hypothalamic nuclei are malformed in weanling offspring of low protein malnourished rat dams. J Nutr. 2000.
- Roseboom TJ, van der Meulen JH, Ravelli AC, et all. Effects of prenatal exposure to the Dutch famine on adult disease in later life: an overview. Mol Cell Endocrinol. 2001.
- Kanherkar RR, Bhatia-Dey N, Csoka AB. Epigenetics across the human lifespan. Front Cell Dev Biol. 2014; 2: 49.
- Sinclair KD, Allegrucci C, Singh R, et al. DNA methylation, "insulinresistance", and blood pressure in offspring determined by maternal periconceptional B vitamin and methionine status. Proc Natl Acad Sci USA. 2007;104:19351–19356.
- Weinhold B. Epigenetics: The Science of Change. Environmental Health Perspectives. 2006.
- Anway MD1, Cupp AS, Uzumcu M, Skinner MK. Epigenetic transgenerational actions of endocrine disruptors and male fertility. Science. 2005 Jun 3;308(5727):1466-9.
- Padmanabhan N, Jia D, Geary-Joo C, Wu , Ferguson-Smith AC, Fung E. et all. Mutation in Folate Metabolism Causes Epigenetic Instability and Transgenerational Effects on Development. J. Cell, 2013 Sept. 2.
- Langley-Evans SC. Developmental programming of health and disease. Proc Nutr Soc. 2006.
- Khan IY, Taylor PD, Dekou V et all. Gender-linked hypertension in offspring of lard-fed pregnant rats. Hypertension. 2003.
- Daenzer M, Ortmann S, Klaus S, Metges CC. Prenatal high protein exposure decreases energy expenditure and increases adiposity in young rats. J Nutr. 2002.
- Langley-Evans SC, Bellinger L, McMullen S. Animal models of programming: early life influences on appetite and feeding behaviour. Matern Child Nutr. 2005.
- Samuelsson AM, Matthews PA, Argenton M, Christie MR, McConnell JM, Jansen EHJM et all. Diet-Induced Obesity in Female Mice Leads to Offspring Hyperphagia, Adiposity, Hypertension, and "InsulinResistance". A Novel Murine Model of Developmental Programming. Hypertension. 2008;51:383-392.
- Daraki V, Georgiou V, Chalkiadaki G, Karachaliou M, Koinaki S. Metabolic dysregulation in early pregnancy in association with offspring cardiometabolic risk in preschool children. Program of prevention and early diagnostic of obesity and neurodevelopment disorders in preschool age children, Crete, Greece, NSRF 2007-2013 project, MIS 349580.
- Pembrey ME, Bygren LO, Kaati G, Edvinsson S, Northstone K, Sjöström M, Golding J, ALSPAC Study Team. Sex-specific, male-line transgenerational responses in humans. Eur J Hum Genet. 2006 Feb; 14(2):159-66.
- Curley JP, Mashoodh R, Champagne FA. Epigenetics and the Origins of Paternal Effects. Hormones and behavior. 2011;59(3):306-314.


Commenti